阿尔茨海默病(Alzheimer's disease, AD)是导致痴呆的主要原因,其特征是大脑中淀粉样斑块和tau原纤维缠结的积累。早发性阿尔茨海默病(Early-Onset Alzheimer’s Disease, EOAD)或家族性AD(Familial Alzheimer’s Disease, FAD)通常由淀粉样前体蛋白(APP)、早老蛋白1(PSEN1)和早老蛋白2(PSEN2)编码基因突变引起。散发性AD(Sporadic Alzheimer’s Disease, SAD)或晚发性AD(Late-Onset Alzheimer’s Disease, LOAD)更常见(> 95%),症状出现在65岁以后,其危险因素包括年龄、载脂蛋白E(APOE)ε4等位基因和髓系细胞上表达的触发受体2的点突变(TREM2),女性面临的风险更高并占大多数病例,且女性APOE ε4携带者比男性携带者患AD的风险更大。
与AD相关的病理生理变化比临床症状开始早几十年。代谢衰退是最早的症状之一,轻度认知障碍(Mild Cognitive Impairment, MCI)患者的糖摄取减少。此外,在动物模型和AD感染个体中,糖代谢中断与早期线粒体功能障碍有关。与健康个体相比,MCI患者的赖氨酸代谢、三羧酸循环和脂质代谢等多种代谢网络均存在扰动。这表明,代谢功能障碍可能在疾病的早期阶段发挥重要作用。
动物模型对于理解AD的发展和进展以及在受控环境中对疾病相关危险因素的研究至关重要。具有APP和PSEN1基因突变的转基因小鼠模型被广泛用于研究生物液体和脑代谢组,并发现在AD患者中发现的受影响的代谢通路存在显著重叠。然而,这些小鼠模型仅限于代表少量AD病例的FAD转基因模型,而以往的研究没有研究性别特异性差异对代谢变化的影响。

2024年3月Ravi S. Pandey、Mattias Arnold、Richa Batra、Jan Krumsiek等人在《Alzheimer’s & Dementia》发表了一篇题为《Metabolomics profiling reveals distinct, sex-specific signatures in serum and brain metabolomes in mouse models of Alzheimer’s disease》的文章(IF=13,DOI:10.1002/alz.13851)。该研究为了弥补性别特异性差异对代谢变化影响的研究空白,选用了三组小鼠模型(B6、LOAD1和5XFAD)进行研究其代谢物(共142个)的性别特异性关联。结果表明,在血清代谢组中有73个代谢物与性别显著相关,在脑代谢组中有34个代谢物与性别显著相关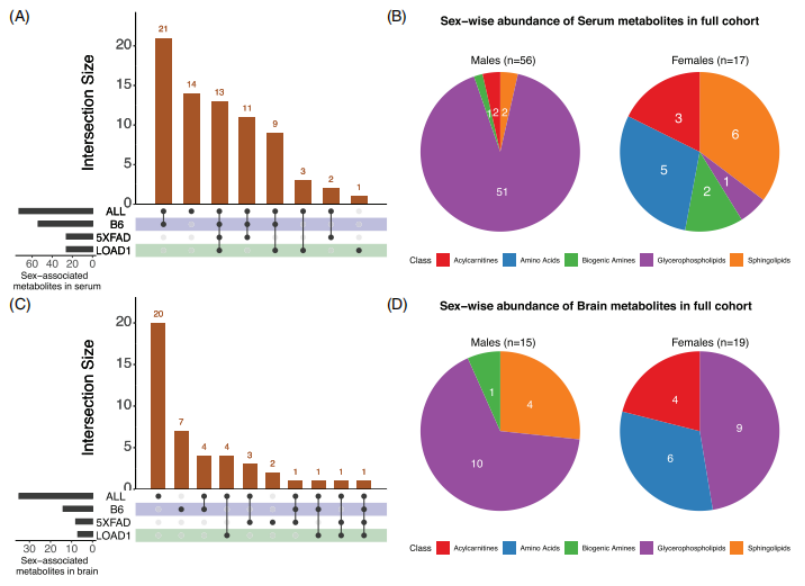 图1小鼠模型中的性别代谢物关联。
图1小鼠模型中的性别代谢物关联。
之后,研究者们探究了代谢物与AD危险因素之间的关系,以及性别是否改变了AD危险因素与代谢物浓度之间的关系。结果表明,在血清代谢组中LOAD1显著相关的代谢物多于5XFAD(图2A),在脑代谢组中5XFAD显著相关的代谢物多于LOAD1(图2B);与B6对照组相比,男性LOAD1组的血清代谢组中缬氨酸和异亮氨酸的水平显著升高(图2C、图2D)。
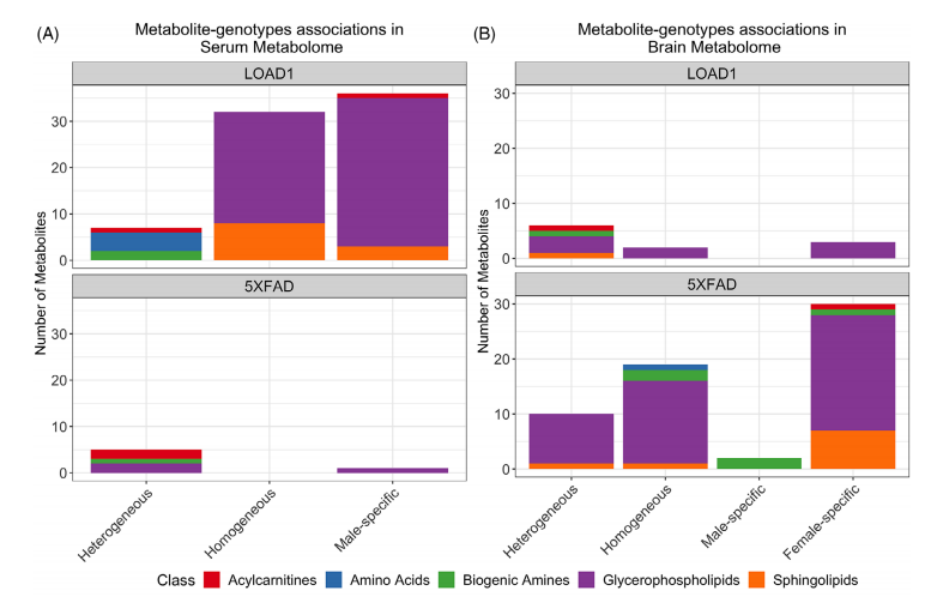

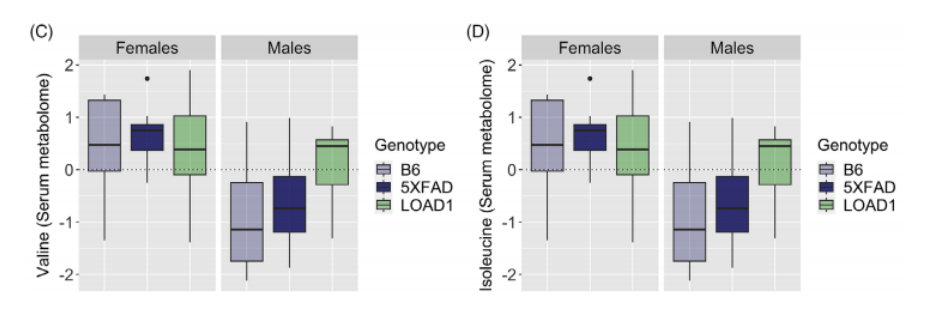

图2在小鼠模型中,按性别分层的代谢物与LOAD1和5XFAD基因型的关系。
最后,研究者们进行了小鼠代谢组谱和人类代谢组谱的研究比较。分别对阿尔茨海默病神经影像学倡议(Alzheimer’s Disease Neuroimaging Initiative, ADNI)队列和拉什大学宗教秩序研究和记忆与衰老项目(Rush Religious Order Study and Memory and Aging Project, ROS/MAP)队列进行比对,研究APOE ε4携带者中人和小鼠代谢组学特征之间的相关性。结果表明两个队列的人群与小鼠血清效应和脑效应均呈显著正相关(图3)。
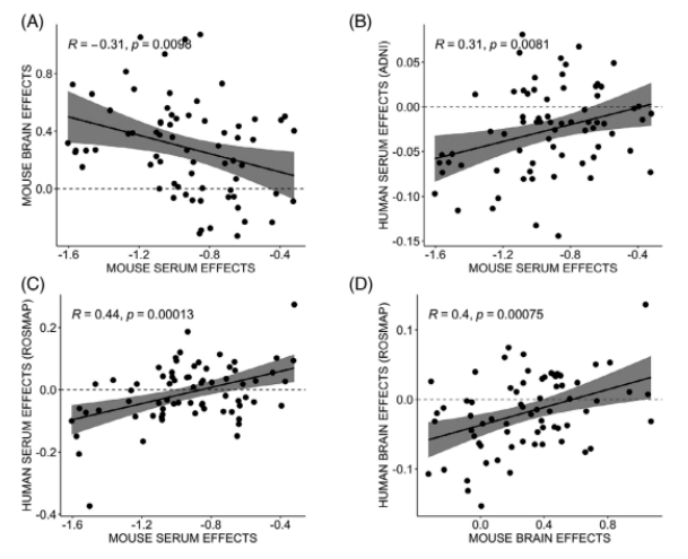
图3 APOE ε4携带者中人和小鼠代谢组学特征之间的相关性。
总之,该项研究表明了在AD小鼠模型中,大脑和血清之间的代谢组学特征显著不同,早发5XFAD小鼠在大脑中表现出更强的作用,而晚发LOAD1小鼠在血清中表现出更明显的作用。并且在小鼠模型中识别出与人类AD风险相关的代谢变化模式,这些发现则加强了小鼠模型在研究人类AD早期发生的代谢变化方面的实用性。