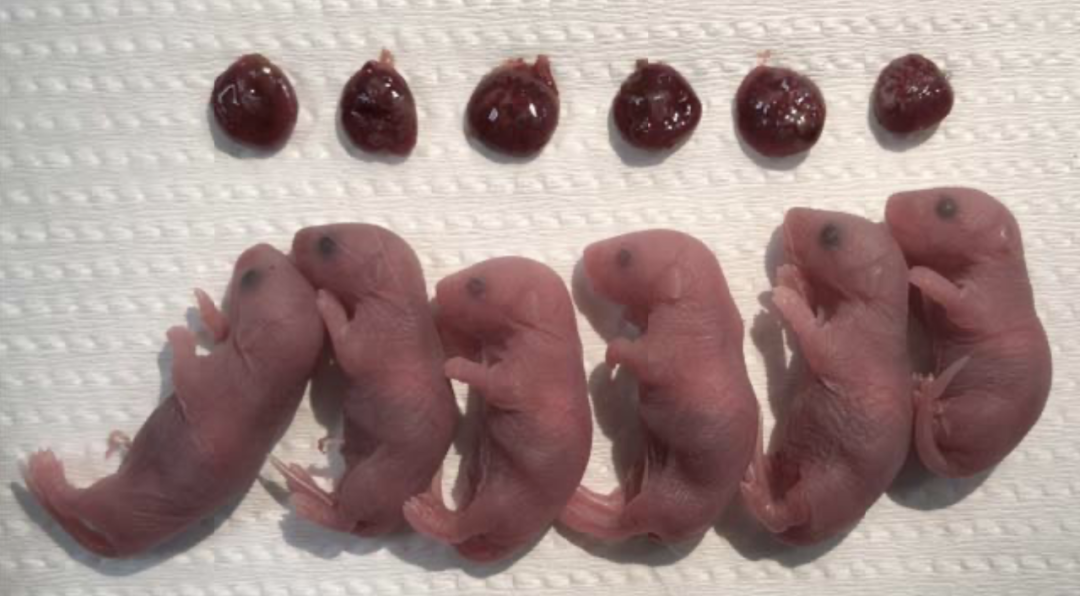
近日,日本的科研人员在干细胞领域取得新突破。他们用小鼠胚胎干细胞,制造出了卵母细胞成熟所需的结构——卵巢中的卵泡。在干细胞制造的“体外卵泡”中,原始生殖细胞得以生成具有完整功能的卵子,这些卵子最终受精并孕育出了健康的小鼠后代。
该研究成果被发表在《科学》杂志上,题为《Generation of ovarian follicles from mouse pluripotent stem cells 》。专家评论:“这项技术突破激发了生殖细胞研究的巨大潜力。”

在过去的研究中,科学家们已经可以使用小鼠的胚胎干细胞造出卵母细胞,也就是卵子的前体。但这些前体细胞必须移植回雌性动物体内,或者从动物体内分离出卵巢细胞,才能进一步产生卵子。
这是因为,卵母细胞需要在一个充满液体的特殊囊泡中成熟。这个囊泡叫做卵泡,组成卵泡的体细胞提供了多种营养成分和信号分子,支持卵母细胞的生长和分裂。
九州大学的科研人员成功创建了可供卵子发育的卵泡结构,让干细胞制造的卵母细胞可以在体外发育成熟。通过在不同时间点提供不同的信息分子,研究团队成功诱导雌性小鼠的胚胎干细胞逐步分化,最终产生了大量与卵巢体细胞类似的细胞。他们将其命名为胚胎卵巢体细胞样细胞(简称FOSLC)。
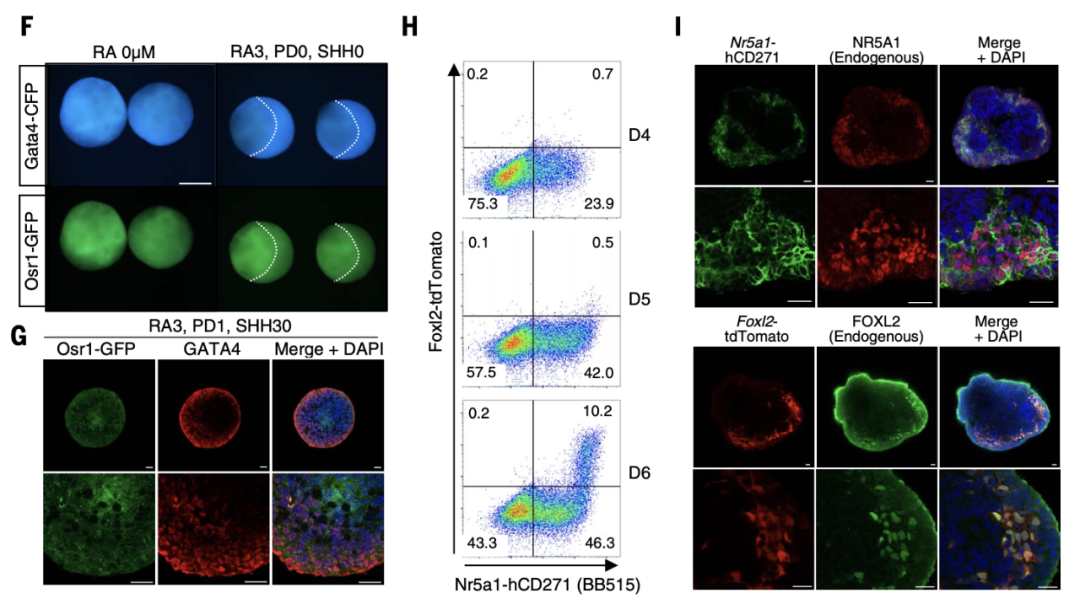
FOSLC 在胚胎第 12.5 天表现出与胚胎卵巢体细胞相似的转录谱和细胞组成。
当这些FOSLC与来自小鼠胚胎干细胞的卵母细胞(PGCLC)放在一起共同培养时,FOSLC产生了卵巢卵泡结构,而PGCLC在里面发育成有活力的卵子。
更可喜的,这些体外生成的卵子完全具有该有的功能:它们可以受精,受精卵产生的胚胎移植到雌性小鼠子宫内,产生了健康、有生育能力的后代。
这一研究结果为小鼠配子生产提供了一种替代方法,并促进了我们对哺乳动物繁殖和发育的理解。
研究人员总结说,这项技术为体外大规模产生卵子提供了一个模型系统,这可能对辅助生殖技术产生影响。