自有人类历史以来,人们追去永生和延缓衰老的探索就从未停止。5月12日,《自然》发布重磅消息,一项关于抗衰的研究取得重大进展。
这项研究来自美国明尼苏达大学科研团队[1],研究者们发现,免疫细胞的衰老竟然不止会导致免疫功能受损,还会促进其他非免疫器官的损伤,并导致小鼠短命。移植衰老免疫细胞,同样会促进衰老和组织损伤;反过来推理,移植“年轻的”免疫细胞,是否一定程度上逆转衰老呢?
在以往的研究中发现,衰老的关键驱动因素为衰老细胞(senescent cell)。衰会随着机体衰老而累积,它们释放一系列促凋亡、促炎、导致干细胞功能紊乱、破坏组织、向正常细胞扩散衰老、衰老相关分泌表型(SASP)的因素。这也导致了与年龄相关的疾病和慢性疾病的发生。
同时,在衰老的过程中,免疫系统会失去对抗病原体和癌细胞的有效反应能力,即免疫衰老。然而,对于老年免疫系统如何导致免疫衰老这个问题,科学界却知之甚少。
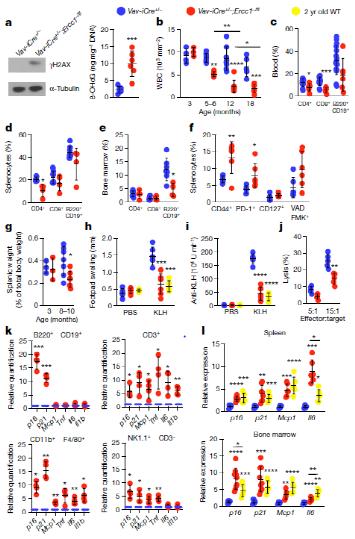
造血细胞中删除ERCC1基因造成免疫系统的加速老化
这项研究的主要结论是内源性DNA损伤容易影响免疫细胞,若不修复,就会导致细胞死亡或衰老,因此衰老的免疫细胞也成为延长健康寿命的关键治疗靶标。与正常衰老一样,实验室中的衰老损害先天免疫和适应性免疫——特别损害滤泡辅助性T细胞和自然杀伤细胞的功能,并潜在地驱动身体器官的衰老。实质损伤的机制似乎是细胞自主性(功能丧失)和细胞非自主性(功能获得,如SASP)的结合。研究人员总结,利用抗衰老药物靶向治疗衰老免疫细胞,在抑制多种老年疾病方面十分具有潜力。
在实验小鼠中,研究者采用特异性敲除ERCC-1的方法来让小鼠的免疫“未老先衰”。ERCC-1是一种DNA修复的关键酶,此前研究显示,降低ERCC-1的表达会阻碍DNA损伤修复,并导致多种氧化损伤和衰老细胞的积累。
随着小鼠的正常出生、长大,成年之前小鼠并没有表现出什么不同。不过在8-10个月时进行检测,可以发现,小鼠脾脏和骨髓组织中DNA氧化损伤水平显著增加了。并且,随着小鼠的成长,其T细胞和B细胞数量显著减少;同时对比正常小鼠,敲除小鼠的淋巴细胞计数也更不稳定。这足够说明,ERCC-1敲除的小鼠,提前衰老了。
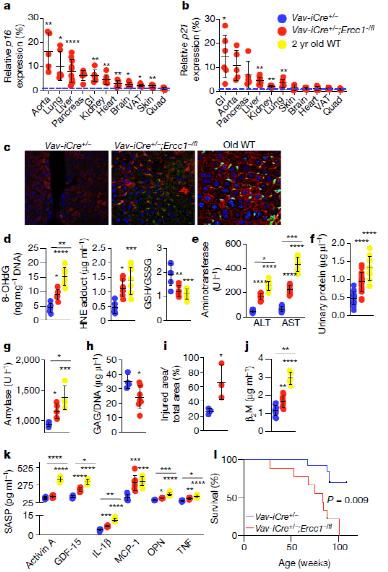
衰老的免疫系统驱动非淋巴器官的衰老和组织稳态的丧失
当研究者将ERCC-1敲除小鼠的脾细胞移植给早衰模式小鼠,小鼠衰上加衰,寿命更短了。
值得注意的是,研究人员将变异小鼠或老年野生型小鼠的脾细胞移植到野生年轻小鼠,发现被移植野生小鼠衰老加速,寿命显著缩短。反之,若将年轻野生小鼠的脾细胞移植到变异小鼠体内,发现被移植变异小鼠的组织衰老有所减缓。证明衰老的免疫细胞可以通过功能获得机制,即加速组织细胞的非自主衰老,但衰老的免疫细胞也具有功能丧失机制,即无法抑制衰老。
研究人员用雷帕霉素(rapamune)治疗变异小鼠,发现雷帕霉素降低了外周T细胞中衰老标记物,使抗KLH血清浓度和白细胞计数增加。说明治疗后,小鼠免疫功能提高,免疫衰老有所好转。这证明免疫衰老可以被调节,且免疫衰老可以驱动全身性衰老。
最后,该研究的通讯作者 Laura Niedernhofer 教授表示:“既然我们已经确定了哪种细胞类型是最有害的,这项工作将引导我们开发靶向衰老免疫细胞的衰老解药。我们还希望它能帮助指导免疫细胞群中的生物标记物的发现,帮助判断哪些人有组织损伤和快速老化的风险,从而判断哪些人最需要衰老治疗。”